Hipertermie
La ora actuală, hipertermia generală (sistemică) și cea locală sunt utilizate în mod curent în cadrul mai multor centre medicale universitare din Europa și Statele Unite.
Hipertermia locală
Procedura
În cadrul acestei forme de terapie, asupra organului sau țesutului afectat de tumoră, sunt direcționate în mod controlat și țintit, cu ajutorul unor aparate speciale, ultrasunete sau curenție electrici de frecvență joasă. Energia astfel produsă este absorbită de mediul extracelular în care se găsesc celulele tumorale, crescând, în consecință, temperatura acestora cu apariția efectelor dorite.
Aparatura folosită transmite în mod controlat doza de energie, determinând încălzirea țesutului până la 42,5 ˚C. Testele de biofizică și biologie celulară au demonstrat că, în zonele în tumorale în care activitatea celulelor este mai intensă, se înregistrează o concentrație ionică mai mare. Ca urmare, conductibilitatea și permisivitatea matricei extracelulare a țesutului malign devine mai mare decât în cazul țesutului sănătos. Această diferență facilitează afectarea aproape exclusivă a celulelor maligne în cazul unei tumori ce conține și celule sănătoase. Această selecție naturală este și mai mult accentuată de comportamentul individual al celulelor tumorale, fiind stimulat, totodată, și răspunsul imun al organismului.
Recomandări
Trialurile clinice (faze II și III) au demonstrat că hipertermia regională este recomandată în cazul tumorilor solide, atât primare cât și metastatice. Terapia poate crește rata de supraviețuire și calitatea vieții pacientului. De asemenea, ea poate fi aplicată în scop paliativ, atunci când terapiile convenționale nu mai sunt indicate sau eficiente.
Oncotermia se utilizează într-un număr mare de cancere precum, cancerul de sân, cancerul de prostată, cancere cu localizare abdominală (stomac, intestin, ficat, pancreas), cancerul pulmonar, cancerul limfatic și diferite alte metastaze. Experiența clinică a arătat că hipertermia locală, în special atunci când este realizată înainte sau după intervenții chirurgicale de eliminare a țesutului tumoral, îmbunătățește parametrii de recuperare a pacientului și scade șansele apariției metastazelor ulterioare.
Frecvența și durata aplicației hipertermiei depinde în totalitate de condiția specifică a pacientului. În general, terapia este extrem de bine tolerată. De obicei, nu sunt înregistrate efecte secundare, chiar și când este administrată concomitent cu alte terapii. Căldura este aplicată local, direct pe țesutul sau organul afectat. În timpul ședinței, care durează aproximativ 60 de minute, pacientul este așezat pe un pat special, fiind sub observația continuă a personalului medical.
Beneficii
Au fost demonstrate următoarele beneficii ale hipertermiei locale:
Chemosensibilizare. Terapia locală, aplicată complementar chimioterapiei clasice, sensibilizează tumorile la acest tratament, prin afectarea integrității membranei celulare tumorale și creșterea permeabilității și a disfuncției structurale și, astfel, creșterea ratei de absorbție a substanțelor chimice administrate. Rezultatele trialurilor clinice, faze II/III, au demonstrat că hipertermia locală, în asociere cu chimioterapia, reprezintă o manieră mai precisă de a administra țintit, în tumoră, medicamentele antitumorale.
Radiosensibilizare. Hipertermia locală sensibilizează tumora la radioterapie atunci când ea este administrată complementar (are loc creșterea aportului de oxigen de la nivelul celulelor). Hipertermia regională efectuată în timpul tratamentelor cu radioterapie îmbunătățește răspunsul pacienților la tratament și șansele de supraviețuire ale acestora. Hipertermia crește oxigenarea și, astfel, reduce hipoxia, amplificând efectul citotoxic al radiației. De asemenea, inhibă procesele de refacere a celulelor tumorale afectate de radiație.
Răspunsul imun. Hipertermia locală activează expresia antigenelor ca urmare a afectării membranei celulare a celulelor tumorale. Cu precădere, eliberarea proteinelor de șoc termic (HSP) ce susțin apariția unui răspuns imun de distrugere a tumorii. Eliberarea, de către celulele tumorale afectate, a proteinelor B1 (HMGB1), ATP și HSP stimulează răspunsul imun al organismului și contribuie, astfel, la efectul antitumoral. Hipertermia locală stimulează și refacerea legăturilor inter-celulare și intermoleculare necesare declanșării apoptozei (moarte celulară programată) și oprirea proceselor de migrare în organism a celulelor tumorale.
Afectarea genică. Studiile au demonstrat că hipertermia locală activează gena tumorală supresoare p53, cu rol în scăderea ratei de diviziune și facilitarea instalării apoptozei.
Efecte adverse și contraindicații
Terapia prezintă riscuri minime la administrare, efectele adverse fiind limitate și rare. Aplicarea unei temperaturi înalte la nivelul tumorii are efecte minime asupra țesuturilor sănătoase adiacente.
Dintre efectele secundare, cel mai des întâlnit este înroșirea ușoară a zonei pe care a fost aplicat tratamentul, însă efectul dispare de la sine ca urmare a funcției sistemului sangvin extrem de ramificat și eficient din țesuturile sănătoase. Acest lucru nu se întâmplă și în tumoră, deoarece ea este irigată de un sistem capilar deficitar.
Terapia este eficientă în toate formele de cancer, dar nu se recomandă aplicată în zonele unde există stimulator cardiac, stenturi metalice dispuse paralel cu așezarea electrodului precum și proteze metalice. Aplicarea terapiei este posibilă la distanță de aproximativ 10-20 cm de aceste zone.
Hipertermie totală
Procedura
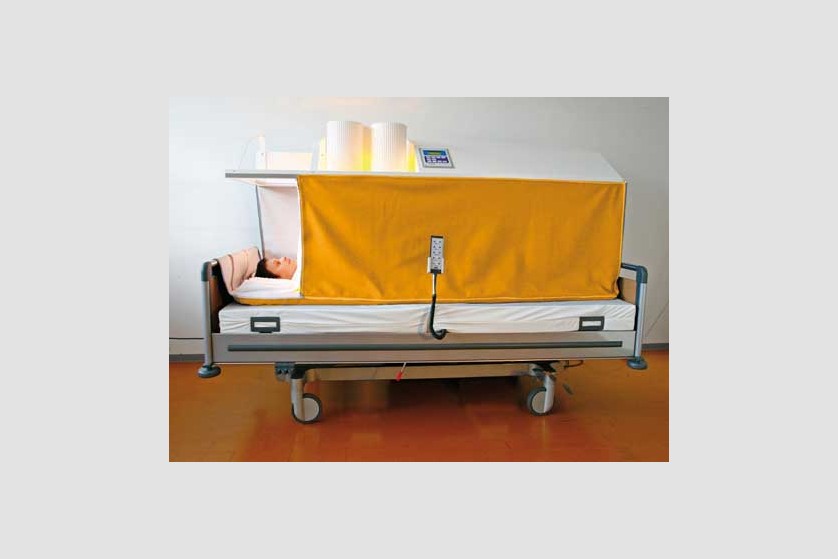
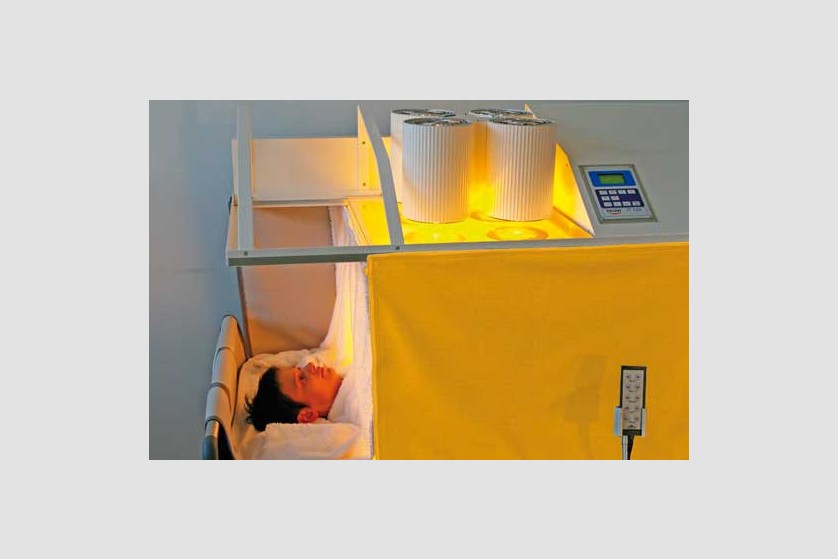
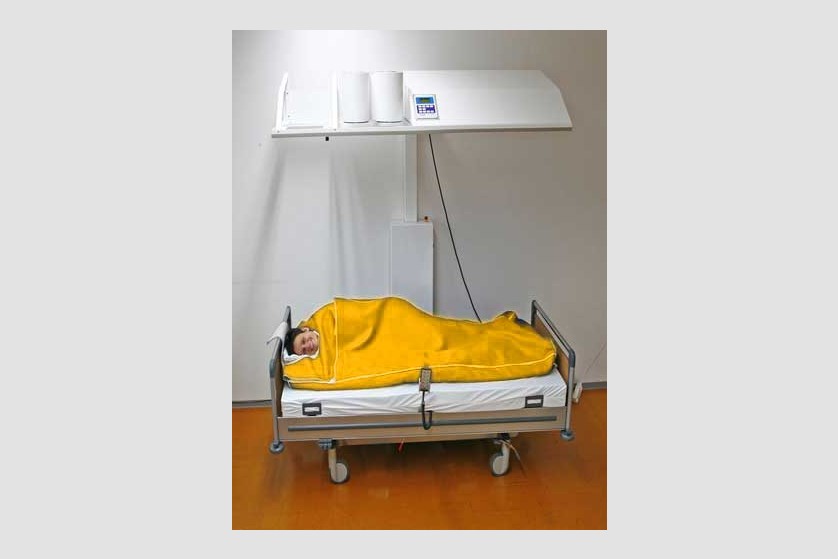
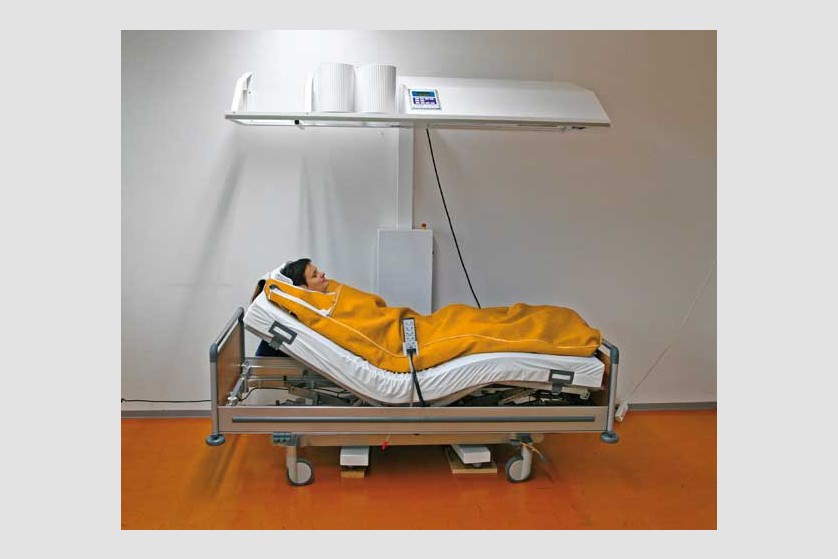
Scopul hipertermiei sistemice este de a induce efectele benefice pe care febra le are în organism. De obicei, pe parcursul a 3 ore, este indusă temperatura de 40-41 ˚C, cu posibilitatea de menținere la 38-40 ˚C timp de 4-8 ore.
Plin aplicarea de căldură întregului organism, hipertermia generală tratează boli sistemice, inclusiv cancer. Ca urmare a vascularizației anormale, metabolismului anaerob și a depleției de nutrienți, tumorile au o sensibilitate termică mai ridicată decât țesuturile sănătoase.
Pacientul este așezat pe un pat special, ajustabil de-a lungul procedurii ce poate dura câteva ore, pentru a asigura comfortul pacientului pe toată durata ședinței. Temperatura corpului este crescută prin aplicarea de radiație infraroșie (IR-A). Pacientul depune un efort minim în timpul acestei proeduri, el se relaxează într-o ambiență placută și comfortabilă, în timpul celor câteva ore de aplicație a temperaturii. Pe durata întregii proceduri sunt monitorizate constant temperatura corporală, ritmul cardiac, oxigenarea, presiunea sangvină, EKG, frecvența respiratorie.
Hipertermia totală se administrează în cicluri de 4-6-8-10-12 ședințe, efectuate consecutiv, la o săptămână distanță între ele.
Recomandări
Tratamentul cu hipertermie poate fi aplicat in toate stadiile de evolutie ale unui cancer.
Numeroase trialuri clinice au studiat efectele tratamentului combinat al hipertermie cu radioterapia sau chimioterapia. Aceste studii s-au centrat pe tratarea mai multor tipuri de cancer precum, sarcoame, melanom, cancer de cap și gât, cancer de creier, pulmonar, esofagian, de sân, de vezică urinară, anal, hepatic, cervical, peritoneal. Multe din aceste studii au arătat apariția unei reduceri semnificative în volum a tumorii, atunci când hipertermia a fost combinată cu alte forme de tratament.
Principalele argumente ale utilizării hipertermiei generale/sistemice sunt următoarele:
în comparație cu celulele sănătoase, celulele canceroase devin mult mai sensibile, dezvoltând chiar o intoleranță față de efectele căldurii excesive,
- pentru că tumorile nu au capacitatea de a-și adapta circulația sângelui la efectele temperaturilor ridicate, este înregistrată o scădere a aportului sangvin la nivelul acestora,
- temperaturile mai mari de 41˚C determină apariția acidozei în celulele canceroase, lucru ce scade viabilitatea și capacitatea lor de diviziune,
- temperaturile ridicate determină activarea sistemului imunitar al organismului, cu creșterea producției de interferon. Reputatul medic german Rolf Issels a observat că hipertermia crește concentrația proteinelor de șoc termic (HSP) de pe suprafața celulelor canceroase, predispunându-le, astfel, la atacurile sistemului imunitar,
- hipertermia sistemică poate fi utilizată cu succes în cazul cancerelor metastatice.
Masa tumorală, în miezul ei, conține celulele ce trăiesc într-o stare de hipoxie (cu puțin oxigen). Aceste celule au rezistență la tratamentul cu radiații, însă sunt foarte sensibile la căldură. Cercetătorii cred că radioterapia distruge celulele oxigenate normal din straturile superioare ale tumorii, în timp ce hipertermia acționează asupra celor din interiorul ei, diminuând considerabil rezistența totală a tumorii la tratamentul cu radiații sau medicamente.
Beneficii
Experiența clinică a arătat că unul din cele mai mari beneficii ale hipertermiei sistemice este cel de creștere a eficienței altor forme de tratament a cancerului. Încălzirea celulelor la temperaturi mai mari decât cele fiziologice le face susceptibile la tratamentul cu radiații și chimioterapice.
Cercetările de specialitate au arătat că, hipertermia sistemică (generală) poate determina:
- maturizarea celulelor dendritice de la nivel cerebral,
- creșterea răspunsului imun (prin interacțiunea celulelor dendritice cu celulele T CD8),
- activarea prelungită a celulelor T imunitare,
- activarea monocitelor și macrofagelor,
- eliberarea factorului tumoral de necroză a (TNFa),
- creșterea numărului de limfocite T și celule natural killer (NK),
- stimularea generală a răspunsului imun al organismului.
În plus, sub influența căldurii, celulele tumorale produc proteine de șoc termic (HSP), specifice celulelor deteriorate din organism și a căror sinteză le face susceptibile distrugerii de către sistemul imunitar. Astfel, hipertermia, stimulează sistemul imunitar să lupte împotriva tumorii.
La ora actuală, hipertermia sistemică este recunoscută oficial ca o metodă clasică, eficientă, de tratament a diferitelor forme de cancer.
Efecte adverse și contraindicații
Contraindicațiile sunt dependente de gradul de elevare a temperaturii propuse și se orientează în funcție de sarcina negativă exercitată asupra sistemului circulator și eventualitatea creării unei activări nedorite a inflamațiilor precum și a unei destabilizări ale constelațiilor labile hormonale și metabolice:
• infecții acute,
• deshidratare excesivă cu dereglări ale echilibrului hidro-electrolitic în organism, anhidroza,
• insuficiența cardiacă (grad > 2),
• ateroscleroză avansată, infarct miocardic; tulburări de ritm cardiac - (premergător tratamentului hipertermic sunt necesare analize cardiace),
• circulație cerebrală deficitară extremă, tumori cerebrale, eventual edeme cerebrale; în cazul afecțiunilor cu o rată intensă a metastazei canceroase se necesită un examen medical precedent terapiei hipertermice (apariția convulsiilor în timpul tratamentului hipertermic oncologic indică existenta metastazelor cancerigene cerebrale care încă nu au fost diagnosticate, fapt ce duce la întreruperea imediata a sesiunilor terapeutice),
• insuficiența manifestă a organelor interne precum plămânii, ficatul, rinichii, măduva osoasă referitor la neoplaziile obstructive sau/ori procese inflamatorii distructive,
• tromboze diagnosticate sau suspectate, medicamentul anticoagulant Marcumar, boala oclusivă arterială periferică (în cazul varicozelor venoase se vor suspenda și acoperii picioarele pacientului),
• în cazul bolilor cu accese puternice a căror tratamente prezintă rezultate nesatisfăcătoare precum scleroza multiplă,
• în cazul acceselor poliartritei cronice primare-evolutive (artrita reumatoidă),
• crize hormonale și metabolice precum hipertiroidismul și porfirie,
• diabetul zaharat (Diabetes Mellitus) și hipertonia musculară necesită o întrerupere permanentă în avans,
• saturația oxigenului scăzută sub 92%,
• stare precară a sănătății generale al pacientului în stadiile avansate ale unei boli prezente (grad OMS 3 sau 4),
• situații psihiatrice limită,
• graviditate și alăptare,
• limfedemul diagnosticat se poate accentua în urma tratamentului hipertermic din cauza vasodilatației produse. Pentru a începe un tratament hipertermic, conștient de riscurile menționate mai sus, pacientul trebuie să fie informat asupra gravității acestei decizii. Într-un caz afirmativ, procesul hipertermic va fi acompaniat de medicații adjuvante precum (enzimoterapia).
Principalele reacții adverse sunt:
• suprasolicitarea sistemului circulator și a reglării temperaturii centrale a corpului în situațiile în care acestuia i se impune creșterea forțată a temperaturii de la valoarea de referință de 37ºC la o valoare reală mult mai elevată,
• suprasolicitarea termică a arterelor principale afectate de malperfuzie (ischemie) sau cu alte proprietății speciale,
• efectele nedorite ale stimulării sistemului imunitar și a perfuziei coronariene.
Scurt istoric
Hipertermia a fost utilizată încă din Grecia Antică, medicii elini recunoscând, încă de atunci, valoarea terapeutică a febrei. În secolul al XIX-lea, câțiva medici germani au observat diminuarea sau vindecarea sarcoamelor la pacienții cu infecții și care aveau febră pentru perioade îndelungate. Tot în secolul XIX, medicul american William Coley a raportat cazuri de vindecare la pacienții cu cancer ca urmare a administrării de endotoxine bacteriene (substanțe produse de bacterii și care, în organismul gazdei pot induce apariția unui răspuns imunitar puternic, a unei boli specifice), cunoscute astăzi sub denumirea de ”vaccinul Coley cu bacterii mixte”.
Din anul 1951, medicul german Josef M. Issels a început administrarea sistematică a acestei terapii la pacienții diagnosticați cu cancer, rezultatele obținute fiind extrem de încurajatoare.
Pe lângă inducerea controlată a febrei cu ajutorul patogenilor sau a toxinelor, toate formele de hipertermie presupun aplicarea de căldură în/pe organism prin utilizarea de surse externe. Pot fi folosite diferite forme de energie precum, microundele, frecvențele radio și ultrasunetele.
În primele decenii ale secolului XX, când efectele biologice ale creșterii controlate a temperaturii corpului au fost mai bine înțelese, au fost elaborate și perfecționate mai multe dispozitive speciale de aplicare terapeutică a căldurii sistemic sau doar local. Deși hipertermia locală (regională) a fost cea mai des utilizată până acum (tratarea unui anumit țesut, organ sau regiune a corpului), există un interes tot mai mare față de hipertermia sistemică, datorită avantajelor diferite pe care aceasta le oferă.
În martie 2000, în jurnalul medical The Lancet, au fost publicate rezultatele unui trial clinic de șase ani, realizat în Olanda, ce a comparat eficiența radioterapiei și a hipertermiei administrată complementar. Trialul a fost unul randomizat, faza III, și a inclus 358 de pacienți diagnosticați cu diferite forme avansate de cancer (cervical, de vezică urinară, colorectal). Cele mai impresionante rezultate au fost înregistrate în cazul cancerului cervical: eliminarea completă a tumorii la 83% dintre pacienții care efectuaseră tratamentul combinat, comparativ cu 57%, în cazul radioterapiei. În plus, rata de supraviețuire în cazul pacienților tratați cu hipertermie și radioterapie a fost de aproape două ori mai mare decât în cazul celor tratați doar cu radioterapie. Totodată, în cazul pacienților cu tratament combinat, nu au fost observate efecte secundare (amețeli, grețuri, necesitatea spitalizării), ca în cazul celor cu radioterapie. În urma acestor rezultate, guvernul olandez a aprobat administrarea aceastei forme combinate de tratament.
În anul 2009, Societatea Europeană de Oncologie Medicală (ESMO), în cadrul întâlnirii de la Berlin, a prezentat membrilor participanți rezultatele unui trial randomizat ce a comparat eficiența chimioterapiei și a chimioterapiei administrată concomitent cu hipertermia, arătând că rata de supraviețuire s-a dublat în cel de-al doilea grup, de la o medie de 18 luni, la 32 de luni.
Institutul Național de Oncologie din America (NCI) afirmă că ”hipertermia poate sensibiliza anumite celule la radiație sau le poate afecta pe cele care au rezistență la tratamentul cu radiații. Hipertermia permite administrarea cu succes a unor doze mari de chimioterapice, fără a declanșa apariția de efecte secundare importante”.
Cum funcționează această terapie
Hipertermia reprezintă o terapie în care creșterea temperaturii corpului, prin diferite metode, determină afectarea sau distrugerea celulelor canceroase sau crește susceptibilitatea lor la efectele radio- și chemoterapiei. Conform Institutului Național de Oncologie SUA (NCI), această formă neinvazivă de terapie determină micșorarea tumorilor, având un impact minim asupra țesuturilor sănătoase.
Studiile au evidențiat că, în cazul tumorilor tumorilor maligne:
- căldura distruge sau slăbește proteinele și structura celulelor maligne,
- căldura crește fluxul sangvin în tumora afectată, lucru ce crește puterea de penetrare în tumoră a medicamentelor,
- creșterea temperaturii organismului stimulează funcția imunitară,
- distrugerea celulelor maligne ca urmare a inducerii proceselor de necrobioză și apoptoză,
- scăderea rezistenței celulelor maligne la chimioterapie,
- protecția împotriva efectele secundare ale chimioterapiei, atunci când hipertermia este administrată concomitent. De asemenea, permite reducerea dozelor de chimioterapice, scăzând efectele negative asupra țesuturilor sănătoase, cu menținerea activității antineoplazice.
Creșterea semnificativă a temperaturii în țesutul canceros produce diferite efecte asupra micromediului tumoral. Este binecunoscut faptul că celulele canceroase au o activitate metabolică foarte ridicată (necesară diviziunii rapide); cu toate acestea, alimentarea celulelor prin capilarele tumorale este deficitară. Această situație are consecințe fatale asupra celulelor tumorale atunci când zona este încălzită, mai ales dacă această încălzire are loc brusc. Creșterea temperaturii determină scăderea aportului de oxigen și nutrienți în țesutul vizat, lucru ce afectează procesele metabolice și, prin urmare, capacitatea de creștere și diviziune a tumorii. Proteinele și structurile celulare sunt afectate de căldură într-o manieră ireversibilă. Astfel, hipertermia predispune instalarea proceselor premergătoare morții celulare. În plus, studiile au arătat că, în capilarele țesuturilor supuse hipertermiei, are loc o concentrare a celulelor sistemului imunitar.
Efectul antitumoral al hipertermiei
Hipertermia determină numeroase modificări la nivel celular, modificări ce conduc la o alterare a homeostaziei celulare. Unul din cele mai relevante efecte ce pot apărea este cel al denaturării și agregării proteice ce determină, mai departe, blocarea ciclului celular, inactivarea sintezei proteice și inhibarea proceselor reparatorii ale ADN-ului. Alte efecte biochimice determinate de hipertermie sunt: inhibarea sintezei ADN, a transcripției și a translației; amplificarea proceselor de degradare proteică, prin intermediul căilor lizozomale și proteozomale; afectarea integrității citoscheletului membranar; modificări metabolice (ex., afectarea proceselor de fosforilare oxidativă) ce conduc la o scădere a nivelelor de ATP; alterări ale permeabilității membranare, ce cauzează creșterea fluxului intracelular de Na+, H+ și Ca2+.
Studiile au demonstrat că modificările vâscozității membranare sunt urmate de o creștere a activității pompei sodiu-potasiu-ATP-dependentă, fapt ce menține nivelul membranar al Na+și al K+ la valori opuse gradientului de concentrație. În timpul tratamentului de hipertermie, permeabilitatea membranară față de anumiți compuși este alterată (ex., poliamine, glucoză și chimioterapice).
În ciuda numărului important de studii realizate cu privire la modificările celulare ce au locul în timpul hipertermiei, natura leziunilor ce determină moartea celulară este încă puțin înțeleasă. Se pare că proteinele sunt primele afectate de hipertermie (39 - 45°C). Alterarea homeostaziei celulare apare după ce expunerea la temperaturile ridicate determină o serie de modificări translaționale precum, glicozilare, acilare, fosforilare și ubiquitinare. Câteva studii au raportat fragmentarea ADN și formarea de rupturi dublu-catenare ca urmare a hipertermiei. Cu toate acestea, se pare că afectarea proteinelor nucleare este efectul-cheie al terapiei, și nu lezarea directă a ADN-ului. Proteinele nucleare, cu precădere, par a avea o sensibilitate ridicată față de temperaturile mari, suferind foarte rapid procese de agregare. Studiile de laborator au demonstrat că agreagarea proteică nucleară determină inhibarea transcripției și a reaplicării ADN. Astfel, diviziunea celulară și creșterea tumorală sunt oprite.
Temperaturile ridicate pot determina o creștere a incidenței reacțiilor biochimice, cu creșterea metabolismului celular și, astfel, a stării de stres oxidativ. Studiile au demonstrat că nivelul speciilor reactive de oxigen (ROS) a crescut în urma expunerii la temperaturi letale ((≥42°C) sau neletale (40°C). Această creștere a nivelului ROS este pusă, mai ales, pe seama creșterii generării de radical superoxid și peroxid de hidrogen (H2O2), ca urmare a afectării lanțului respirator mitocondrial. Alte surse de ROS sunt enzimele NADPH oxidaza și xantin oxidaza, a căror activitate este stimulată o dată cu creșterea temperaturii. De asemenea, hipertermia determină și creșterea reactivității acestor ROS – cercetătorii au observat o creștere a citotoxicității cauzate de H2O2 o dată cu creșterea temperaturii de la valori fiziologice (37°C), la valori anormale (41°C - 43°C).
Una din consecințele determinate de aceste tulburări celulare este afectarea mitozei, arestul permanent în G1 și pierderea capacității celulare clonogenice sau reproductive. Moartea celulară poate fi indusă prin procese precum apoptoza și/sau necroza, funcție de tipul celulei, dar și de temperatura și durata expunerii la căldură. O altă consecință este cea a sensibilizării celulelor față de tratamentul antitumoral clasic, precum radiația. Sunt raportate disfuncții centrozomale și mitotice ca urmare a termo-radiosensibilizării.
La șobolanii cu fibrosarcom
și cancer de colon tratați cu hipertermie sistemică (41,5°C timp de 2 h), s-a
observat o variație, atât a amplorii, cât și a kineticii apoptozei astfel
induse. În plus, a mai fost observat și faptul că inducția apoptozei a fost mai
pronunțată în țesuturile tumorale, comparativ cu cele sănătoase. Cele mai multe
dintre studiile care au investigat mecanismele de inducere a citotoxicității ca
urmare a expunerii la temperaturi ridicate au concluzionat că apoptoza este
principalul efect antitumoral înregistrată în această terapie.
Dewey WC et al. Radiology 1977; 123(2):463-474.
Milleron RS, Bratton SB. Cell Mol Life Sci 2007; 64(18):2329-2333.
Lindquist S. Annu Rev Biochem 1986; 55:1151-1191.
Roti Roti JL. Int J Hyperthermia 2008; 24(1):3-15.
Lepock JR. Int J Hyperthermia 2005; 21(8):681-687.
Richter K, Haslbeck M, Buchner J. Mol Cell 2010; 40(2):253-266.
Sonna LA et al. J Appl Physiol 2002; 92(4):1725-1742.
Bates DA et al. Cancer Research 1985; 45(10):4895-4899.
Gerner EW et al. Ann N Y Acad Sci 1980; 335:215-233.
Bates DA, Mackillop WJ. Cancer Research 1986; 46(11): 5477-5481.
Bensaude O et al. EXS 1996; 77:199-219.
Kuhl NM, Kunz J, Rensing L. Cell Proliferation 2000; 33(3):147-166.
Lui JC, Kong SK. FEBS Letters 2007; 581(1):109-117.
Katschinski DM et al. Cancer Research 1999; 59(14):3404-3410.
Bettaieb A, Averill-Bates DA. Biochem Cell Biol 2008; 86(6):521-538.
Pallepati P, Averill-Bates DA. Free Radic Biol Med 2011; 50(6):667-679.
Lord-Fontaine S, Averill DA. Arch Biochem Biophys 1999; 363(2):283-295.
Samali A et al. FEBS Lett 1999; 461(3):306-310.
Hildebrandt B et al. Crit Rev Oncol Hematol 2002; 43(1):33-56.
Nakahata K et al. Int J Hyperthermia 2002; 18(4):332-343.
Mackey MA, Ianzini F. Int J Radiat Biol 2000; 76(2):273-280.
Sakaguchi Y et al. Cancer Research 1995; 55(22):5459-5464.
Bibliografie selectivă
Atanackovic D et al. Cancer Immunol Immunother Epub 2002; 51(11-12):603.
Barni S et al. Biomed Pharmacother 1996; 50:79-84.
Burd R et al. J Cell Physiol 1998; 177(1):137-147.
Issels RD, Wilmanns W, editors. Recent Results in Cancer Research, Vol. 107: Application of Hyperthermia in the Treatment of Cancer.Berlin/Heidelberg: Springer Verlag; 1988.
Kapp DS, Hahn GM, Carlson RW. Principles of Hyperthermia. In: Bast RC Jr., Kufe DW, Pollock RE, et al., editors. Cancer Medicine e.5. 5th ed. Hamilton, Ontario: B.C. Decker Inc., 2000.
Manjili MH et al. Int J Hyperthermia 2002; 18(6): 506-520.
Nauts HC. Bacterial pyrogens: beneficial effects on cancer patients. In: Gautherie M, Albert E, editors. Biomedical Thermology, Progress in Clinical Biological Research. New York:Alan R. Liss; 1982. p 687-696.
Pettigrew RT et al. Br Med J 1974; 4:679.
Robins HI et al. Journal of Clinical Oncology 1993; 11(9):1787-1794.
Shen RN et al. J Clin Immunol 1987; 7(3):246-53.
van der Zee J. Annals of Oncology 2002; 13(8):1173–1184.
Westermann AM et al. European Journal of Cancer 2001; 37(9): 1111-1117.